AMIce - Öffentlicher Teil - Modul Arzneimittel
Datenbankinformation
AMIce - Öffentlicher Teil enthält Teile der Arzneimittelantragsdatenbank des Bundes (AmAnDa), die von den für die Arzneimittelzulassung zuständigen Bundesoberbehörden BfArM, BVL und PEI aktualisiert und gepflegt wird.
Die Datenbestände der Datenbank AMIce-Öffentlicher Teil und des Arzneimittel-Informationssystems von PharmNet.Bund sind identisch. Diese Datenbankinformation gilt daher für beide Datenbanken.
Der Bestand der Arzneimitteldatenbank umfasst Dokumente zu zugelassenen und ehemals zugelassenen Arzneimitteln (ab Stichtag 30.04.1990) sowie zugehörige beschiedene und offene Änderungsanzeigen. Zu Fertigarzneimitteln werden vorwiegend administrative Daten nachgewiesen, darunter u.a. Handelsname, Zulassungsnummer/-datum und Zulassungsstatus.
Datenbankeinstieg
AMIce-Öffentlicher Teil kostenfrei
Datenbankeigenschaften
Sachgebiet: Arzneimittel, Pharmazie
Quellen: Arzneimittel-Informationssystem (AMIce) der für die Arzneimittelzulassung zuständigen Bundesoberbehörden BfArM, BVL und PEI.
Sprache: Deutsch
Zeitraum: 12/2002 bis heute
Umfang: 332.971 (Stand 01/2025)
Aktualisierung: werktäglich
Recherche
Hinweise
Das Modul enthält Informationen zu allen in Deutschland verkehrsfähigen Arzneimitteln und zu Arzneimitteln, deren Zulassung oder Registrierung erloschen ist mit Zugriff auf deren beschiedene und je nach Sicht offene Änderungsanzeigen sowie teilweise auch auf deren Fach- und Gebrauchsinformationen, Öffentlichen Beurteilungsberichten (PAR) und Risikomanagementplänen (RMP) und weitere Dokumente.
Beachten Sie bitte:
- Stichtag für die Datenerfassung ist der 30.04.1990. Verfügbar sind alle Arzneimittel, die zu diesem Zeitpunkt verkehrsfähig waren, und alle Vorgänge, die zu einem späteren Zeitpunkt erfolgten.
- Die Daten zu Blut und Blutprodukten des Paul-Ehrlich-Instituts, die früher in der Zuständigkeit des ehemaligen Bundesgesundheitsamtes (BGA) waren, sind in AMIce - Öffentlicher Teil einschließlich beschiedener Änderungsanzeigen enthalten. Zu Immunglobulinen, Immunsera und Impfstoffen sowie monoklonalen Antikörpern sind in AMIce-Öffentlicher Teil die aktuellen Daten, nicht jedoch die Änderungsanzeigen aufgeführt, Testsera sind nicht vorhanden.
- Die Dokumente enthalten auch Angaben zu eingeleiteten Maßnahmen zur Abwehr von Arzneimittelrisiken, so genannte Pharmakovigilanzverfahren.
- Das Modul Klinische Prüfungen enthält u.a. Ergebnisse zu Klinischen Prüfungen im Rahmen von Zulassungsverfahren. Dieses Modul wird in einem separaten Browser-Fenster geöffnet.
Zu Fertigarzneimitteln werden vorwiegend administrative Daten ausgewiesen wie Handelsname, Zulassungsnummer/-datum und Zulassungsstatus, Art des Zulassungsverfahrens, Angaben zur Verkehrsfähigkeit, Adressen der pharmazeutischen Unternehmen, Darreichungsform, Packungsgrößen, Indikationen, der Anatomisch-Therapeutisch-Chemische Code der WHO (ATC-Code) und die Zusammensetzung.
Grundsätzlich sind alle Arzneimittel- und Zulassungsdaten, die zur Veröffentlichung zur Verfügung stehen, seit 13. Februar 2025 kostenfrei zugänglich.
Datenfelder
Das ganze Informationssystem befindet sich in permanenter Pflege und wird fortlaufend ergänzt. Die untenstehenden Angaben sind Beispiele und müssen keinen tatsächlichen Datensätzen entsprechen.
| Feldbezeichnung | Beispiele | Anmerkungen |
|---|---|---|
| Arzneimittelname | aspirin protect 100mg | Im Rahmen der Zulassung angegebene Fertigarzneimittelbezeichnung. Name kann mit ? abgekürzt werden. |
| Arzneimittelname (historisch) | aspirin | In der Vergangenheit gültige Arzneimittelbezeichnung |
| Anwendungsart | Zum Einnehmen | |
| Anwendungsgebiete | ?Migräne? | Freitextfeld |
| Anzahl Wirkstoffe (/Teil) | 02 | Zahl der arzneilich wirksamen Bestandteile im jeweiligen Fertigarzneimittel. Bei Arzneimitteln mit mehreren Komponenten bezieht sich die Angabe auf den jeweiligen Teil. |
| AM-Klassifikation (Code) | ?liefer? | Ergänzende Arzneimittelinformation, z.B. hinsichtlich Anti-Doping-Liste, Lieferengpass, etc. |
| Darreichungsform | brausetablette | |
| EU-Zulassungs-Code | ? | Differenzierung des europäischen Zulassungsverfahrens (zentral, dezentral). Fragezeichen eingeben und auf Button Index klicken. Aus Liste den gewünschten Code auswählen (z.B.: Zentrales Zulassungsverfahren der EU). |
| Eingangsnummer | 0245718 | Durch Zulassungsstelle zugeteilte, i.d.R. 7-stellige Nummer. |
| Indikation (ATC-Text) | ?analgetikum? | Zugelassene Indikation in Worten (WHO). |
| Indikation (ATC-Code) | n02ba01 | Zugelassene Indikation codiert (WHO). |
| Kennziffer | 00/01/096 | Durch DDR-Behörden zugeteilte "Zulassungsnummer". |
| Pharma. Unternehmer - Name | bayer bitterfeld ? | Name des PU (differenzierbar in Zulassungsinhaber, Hersteller/Endfreigabe, Vertreiber). Namen maskieren. |
| Pharma. Unternehmer – Nr. | 8038953 | Seitens der Zulassungsstelle dem PU zugeordnete Nummer. |
| Phytopharmakon | ? | Reine und zusammengesetzte Phytopharmaka selektierbar. Fragezeichen eingeben und auf Button "Index" klicken. Aus Liste den gewünschten Code auswählen (z.B: 1... Phytopharmakon). |
| Stoffname | acetylsalicylsaeure | Bezeichnung des arzneilich wirksamen Bestandteils (Wirkstoff), des wirksamen Bestandteils oder des Hilfsstoffs. |
| Tierart | Pferd? | Tierarten, bei denen die Anwendung des Tierarzneimittels zugelassen ist |
| Zul.-Nr./Reg.-Nr. (AMG76)Register-Nr. (AMG61) | 6245718.00.00 | Zulassungs- beziehungsweise Registriernummer. |
| Register-Nr. (AMG61) | a1258 | Nummer der Eintragung in das Spezialitätenregister. |
| Zulassungsstatus | Zugelassen | Zugelassen, verlängert, erloschen, etc.; mögliche Auswahl kann über die Schaltfläche „Index“ eingesehen werden |
| Zuständigkeit | bfarm | Für die Zulassung zuständige Bundesoberbehörde (BfArM, BVL, PEI). |
Suchbeispiel
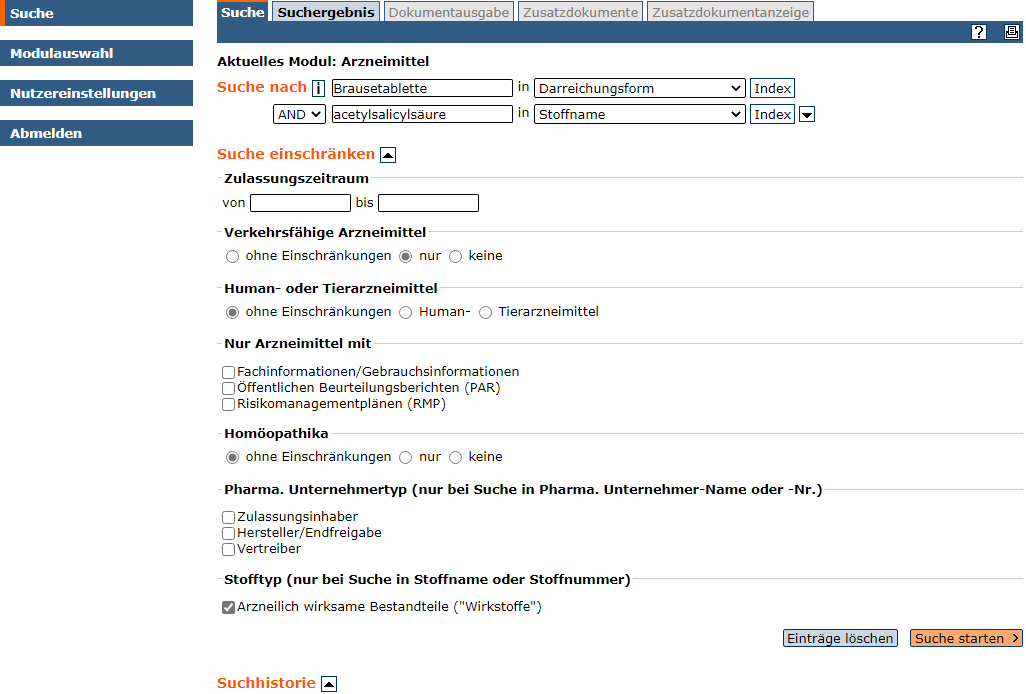
Thema: Gesucht werden alle Arzneimittel, die den Stoff Acetylsalicylsäure als arzneilich wirksamen Bestandteil enthalten und verkehrsfähig sind (Stand: Dezember 2020).
Gezeigt wird nicht der vollständige Ablauf der Suche, sondern nur der erste Eingabebildschirm und weitere wichtige Auswahlbildschirme.
Für eine Suche nach Arzneimitteln sind folgende Funktionen verfügbar:
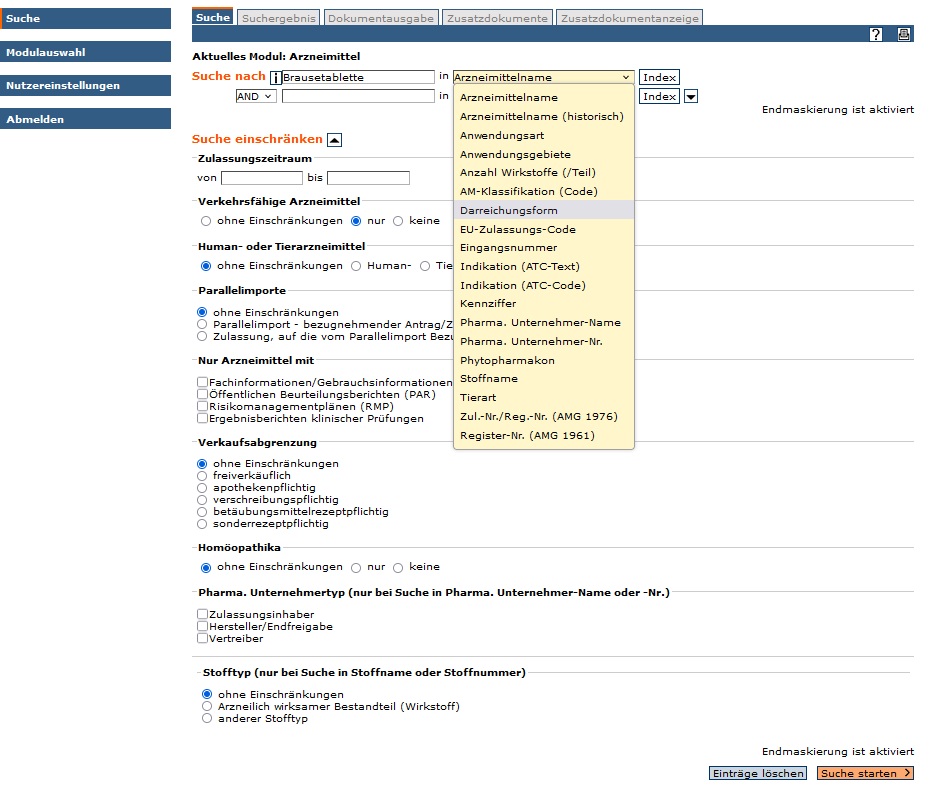
- Die Auswahl und Eingabe von Suchbegriffen ist in einem einzigen Bildschirm möglich.
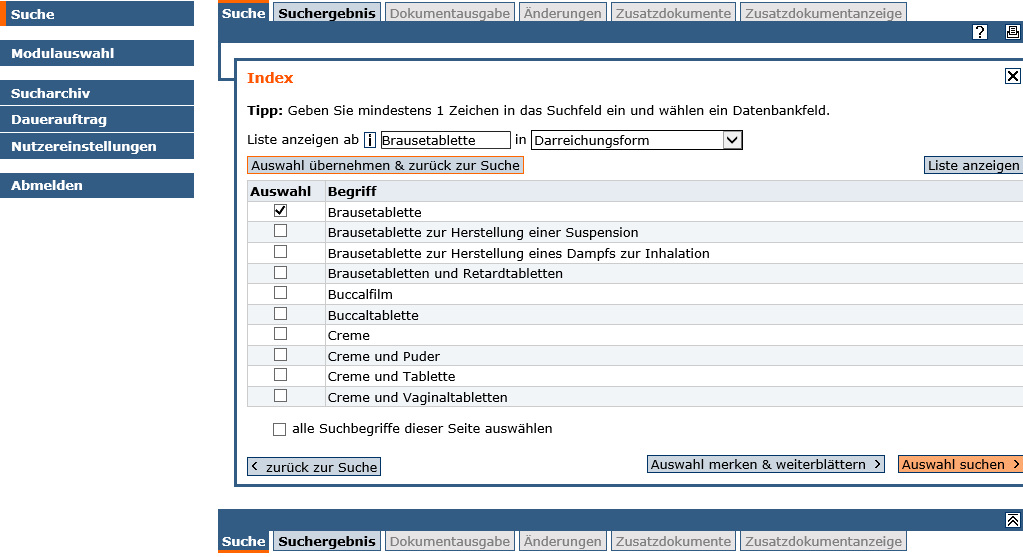
- Diese können entweder direkt (ggf. durch geeignete "Maskierung" (* oder ?)), in das entsprechende Feld eingetragen, oder aus dem Index der möglichen Suchbegriffe in das Suchformular übernommen werden.
- Eine differenzierte Suche ist über die Verknüpfungsmöglichkeiten (AND, OR, NOT) einzelner Suchschritte durchführbar. Einschränkungsmöglichkeiten können über den Link "Filter" aufgerufen werden.
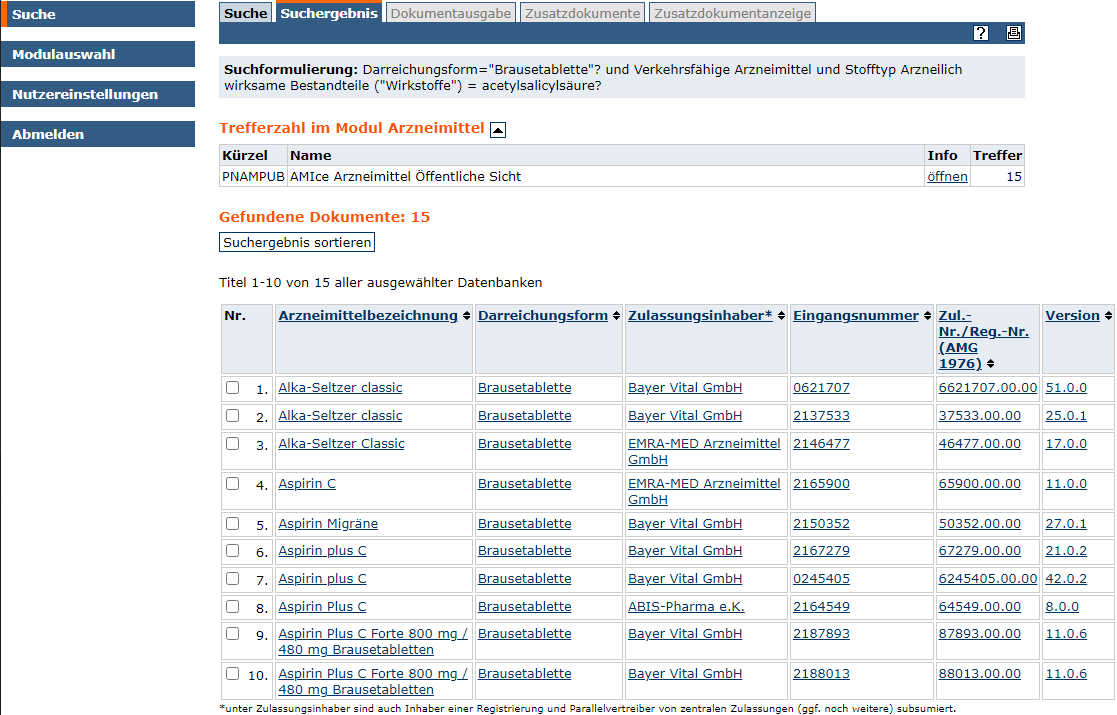
- Einzelne Dokumente aus dem Gesamtergebnis können direkt über den Titel angezeigt werden.
- Zu weiteren Dokumenten gelangen Sie über "weiter".
- Mehrere Dokumente lassen sich in tabellarischer Form als csv-Datei herunterladen.
- Bei der Ausführung einer Suche kann eine automatische End-Maskierung von Suchbegriffen unter "Voreinstellungen" ein- oder ausgeschaltet werden.
Im Suchformular sind folgende Einstellungen möglich:
Im Ergebnis-Tab können Zielinformationen weiterbearbeitet und ausgegeben werden:
Die Änderungshistorie, Stammangaben, sowie weitere, mit dem Arzneimittel verlinkte Texte, finden Sie unter dem Tab Zusatzdokumente.
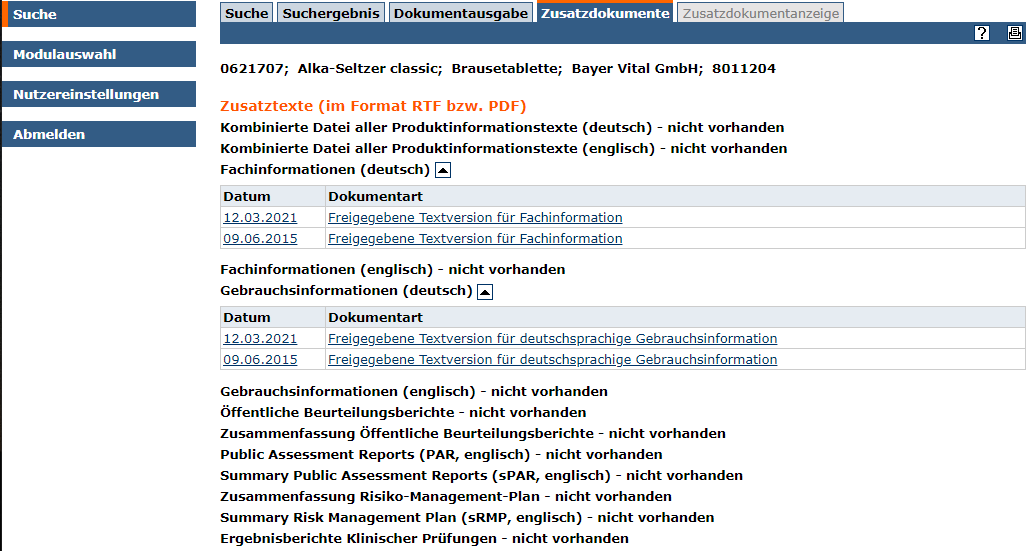
Beispieldokument
Allgemeine Angaben
Eingangsnummer: 0621707
Arzneimittelbezeichnung: Alka-Seltzer classic
Anzahl der Wirkstoffe im AM: 1
Berechnete Stärke: -
Darreichungsform: Brausetablette
Zielgruppe (Domain): Mensch
Status der Version: CURRENT
Hauptversionsnummer: 49.0.0
Anwendungsgebiete
Anwendungsgebiete: Leichte bis mäßig starke Schmerzen, Fieber. (Stand: 16.03.1999)
Indikation/ATC
Indikation/ATC-Code: N02BA01
Indikation/ATC-Bedeutung: Acetylsalicylsäure
Indikation/ATC-Hierarchie:
NERVENSYSTEM
ANALGETIKA
ANDERE ANALGETIKA UND ANTIPYRETIKA
Salicylsäure und Derivate
Acetylsalicylsäure
Administrative Daten
Verkehrsfähigkeit, Zuständigkeit
Verkehrsfähigkeit: Ja
Zuständigkeit: BfArM
Zulassungsinformationen
Zulassungsnummer/ Registrierungsnummer: 6621707.00.00
Datum der Zulassung/Registrierung (Wirksamkeitsdatum): 29.12.1998
Verfahrenstyp: NAP - nationales Verfahren
Antragsart: Nachzulassung gem. §105 (3) AMG
Arzneimitteltyp: -
Status: verlängert
Datum der Verlängerung: 17.07.2009
Ergänzende Zulassungsinformationen
Stammnummer zur Eingangsnummer: 0621707
Registernummer nach AMG 61: A139
Doku.-Info/Nachzulassung: -
Zulassungsnummer/ Registrierungsnummer ION: -
Bescheide
Zulassung
| Bescheidart | Bescheiddatum | Dauer der Gültigkeit | Datum der Postzustellurkunde | Bundesanzeigerdatum | Bundesanzeigernummer |
|---|---|---|---|---|---|
| Fiktive Zulassung | 01.01.1978 | Unbefristet | - | - | - |
| Zulassung | 21.12.1998 | 5 Jahre | 29.12.1998 | 15.04.1999 | 237 |
| Verlängerung | 19.12.2003 | 5 Jahre | 17.02.2005 | 12.01.2006 | 311 |
| Verlängerung | 14.07.2009 | Unbefristet | 17.07.2009 | 16.12.2009 | 363 |
Begründung zur letzten Bescheidart
Verlängerung nach § 31(3) ohne Auflagen erteilt (F=Freigabe)
Letzte Änderungsanzeige
Wirksamkeitsdatum der letzten Änderungsanzeige: 15.01.2020
| Bescheidart | Bescheiddatum | Datum der Postzustellurkunde | Bundesanzeigerdatum |
|---|---|---|---|
| Zustimmung (bei Änderungen) | 15.01.2020 | - | - |
Arzneimittelbeziehungen
Bezugnehmende(s) Arzneimittel (Sohn)
Parallelimport
Eingangsnummer des Sohnarzneimittels: 2146631
Arzneimittelbezeichnung des Sohnarzneimittels: Alka-Seltzer classic
| Land | Initial | Arzneimittelbezeichnung | Zulassungsnummer |
|---|---|---|---|
| Belgien | Ja | 187 IS 216 F03 |
Parallelimport
Eingangsnummer des Sohnarzneimittels: 2163207
Arzneimittelbezeichnung des Sohnarzneimittels: -
| Land | Initial | Arzneimittelbezeichnung | Zulassungsnummer |
|---|---|---|---|
| Frankreich | Ja | 329 268.7 |
Parallelimport
Eingangsnummer des Sohnarzneimittels: 2146477
Arzneimittelbezeichnung des Sohnarzneimittels: Alka-Seltzer Classic
| Land | Initial | Arzneimittelbezeichnung | Zulassungsnummer |
|---|---|---|---|
| Bulgarien | Nein | Alka Seltzer | 20010171 |
| Vereinigtes Königreich | Nein | Alka-Seltzer original | PL 0010/0511 |
| Österreich | Ja | 8.050 | |
| Frankreich | Nein | Alka-Seltzer Comprimés effervescents | 34009 3291104 2 |
| Belgien | Nein | Alka Seltzer | 187 IS 216 F3 |
Parallelimport
Eingangsnummer des Sohnarzneimittels: 2146477
Arzneimittelbezeichnung des Sohnarzneimittels: Alka-Seltzer Classic
| Land | Initial | Arzneimittelbezeichnung | Zulassungsnummer |
|---|---|---|---|
| Frankreich | Nein | Alka-Seltzer Comprimés effervescents | 34009 3291104 2 |
| Belgien | Nein | Alka Seltzer | 187 IS 216 F3 |
| Bulgarien | Nein | Alka Seltzer | 20010171 |
| Vereinigtes Königreich | Nein | Alka-Seltzer original | PL 0010/0511 |
| Österreich | Ja | 8.050 |
Parallelimport
Eingangsnummer des Sohnarzneimittels: 2146613
Arzneimittelbezeichnung des Sohnarzneimittels: Alka-Seltzer
| Land | Initial | Arzneimittelbezeichnung | Zulassungsnummer |
|---|---|---|---|
| Belgien | Ja | 187 IS 216 F3 | |
| Frankreich | Nein | Alka Seltzer | 329268.7; 329110.4 |
| Bulgarien | Nein | Alka Seltzer | 20010171 |
Pharmazeutische Unternehmer
Zulassungsinhaber
PU-Nummer: 8011204
Name: Bayer Vital GmbH
Straße Hausnummer: Kaiser-Wilhelm-Allee 70
PLZ Ort: 51373 Leverkusen
Regierungsbezirk: Köln
Bundesland: Nordrhein-Westfalen
Hersteller Endfreigabe
PU-Nummer: 8038953
Name: Bayer Bitterfeld GmbH
Straße Hausnummer: Salegaster Chaussee 1
PLZ Ort: 06803 Bitterfeld-Wolfen
Regierungsbezirk: -
Bundesland: Sachsen-Anhalt
Zusammensetzung
Anzahl der Teile (Pharmazeutische Produkte, PPT): 1
Teil 1 - Brausetablette
Laufende Nummer des PPT: 1
Reihenfolge des PPT: 1
Name: -
Teil-Darreichungsform: Brausetablette
Anwendungsart: Einnehmen nach Auflösen
Mengenangabe Bezugsmenge: 1 Stück
Anzahl arzneilich wirksamer Bestandteile: 1
Wirkstoffe
| ASK-Nr. | Stoffname | Potenz | Stoffmenge | Stoffmenge maximal | Maßeinheit | Ort | Bemerkung | Nr. |
|---|---|---|---|---|---|---|---|---|
| 2 | Acetylsalicylsäure (Ph.Eur.) | - | 324 | - | Milligramm | - | - | 1 |
Sonstige wirksame Bestandteile
| ASK-Nr. | Stoffname | Potenz | Stoffmenge | Stoffmenge maximal | Maßeinheit | Ort | Bemerkung | Nr. |
|---|---|---|---|---|---|---|---|---|
| 207 | Natriumbenzoat | - | 0,015 | - | Milligramm | - | - | 2 |
Andere Bestandteile
| ASK-Nr. | Stoffname | Potenz | Stoffmenge | Stoffmenge maximal | Maßeinheit | Ort | Bemerkung | Nr. |
|---|---|---|---|---|---|---|---|---|
| 85 | Citronensäure | - | - | - | - | - | - | 3 |
| 214 | Natriumhydrogencarbonat | - | - | - | - | - | - | 4 |
| 13374 | Saccharin-Natrium (Ph.Eur.) | - | - | - | - | - | - | 5 |
| 935 | Dimeticon ((mit Angabe der kinematischen Viskosität in cSt)) | - | - | - | - | - | - | 6 |
| 1357 | Povidon ((mit Angaben zur Viskosität)) | - | - | - | - | - | - | 7 |
| 2585 | Docusat-Natrium | - | - | - | - | - | - | 8 |
| 26903 | Calciumtrimetasilicat 5 H<2>O ((Calciumsilicat nach U.S. NF: siehe ASK-Nr. 28991-5)) | - | - | - | - | - | - | 9 |
| 8979 | Lemon-Aroma, 057461/AP, Firmenich | - | - | - | - | - | - | 10 |
| 8983 | Limonen-Aroma, 057653/AP, Firmenich | - | - | - | - | - | - | 11 |
Packungsgrößen-Gruppe/Verkaufsabgrenzung
Packungsgrößen
| Packungsgröße | Innere Behältnisse | Verkaufsabgrenzung | Dauer der Haltbarkeit der Packung | Art der Bedingung der Haltbarkeit / Lagerungsbedingungen |
|---|---|---|---|---|
| Unverkäufliches Muster 24 Stück | 1 x 24 Stück Information nicht vorhanden1 x 24 Stück Information nicht vorhanden | apothekenpflichtig apothekenpflichtig gemäß §43 oder §46 AMG | 3 Jahr(e) | Originalverschlossene Packung Lagerung: Information nicht vorhanden |
| Unverkäufliches Muster 24 Stück | 1 x 24 Stück Information nicht vorhanden | apothekenpflichtig apothekenpflichtig gemäß §43 oder §46 AMG | 3 Jahr(e) | Originalverschlossene Packung Lagerung: Information nicht vorhanden |
Risikoverfahren/Pharmakovigilanz
Entscheidung(en)
Pharmakovigilanzverfahren
Stufenplannummer oder PSUR-Datenbank-Nummer (national): 1983-014
Bezeichnung des Risikoverfahrens: Acetylsalicylsäure (ASS)-haltige Kombi- HAM II
Art des Risikoverfahrens: nationales Stufenplanverfahren
(Europäische) PhVig-Verfahrensnummer: -
Risikobeschreibung: Blutungsgefahr für Schwangere und Neugeborene
Abschließendes Ergebnis: -
Abschlussdatum: 01.10.1980
Stufenplan erfüllt: 0
Datum des Beschlusses der Maßnahme: 21.11.1983
Laufende Nummer: 1
Gremium: -
Nummer des Beschlusses der Maßnahme: -
Pharmakovigilanzverfahren
Stufenplannummer oder PSUR-Datenbank-Nummer (national): 1989-001
Bezeichnung des Risikoverfahrens: Acetylsalicylsäure (ASS)-haltige HAM
Art des Risikoverfahrens: nationales Stufenplanverfahren
(Europäische) PhVig-Verfahrensnummer: -
Risikobeschreibung: Reye-Syndrom bei Kindern und Jugendlichen
Abschließendes Ergebnis: -
Abschlussdatum: 01.10.1980
Stufenplan erfüllt: 0
Pharmakovigilanzverfahren
Stufenplannummer oder PSUR-Datenbank-Nummer (national): 1993-030
Bezeichnung des Risikoverfahrens: Antiphlogistika, nichtsteroidale, zur systemischen Anwendung, HAM
Art des Risikoverfahrens: nationales Stufenplanverfahren
(Europäische) PhVig-Verfahrensnummer: -
Risikobeschreibung: Beeinträchtigung der Infektabwehr (nekrotisierende Fasciitis)
Abschließendes Ergebnis: Ausgenommen wurden Homoeopathika, sowie AM mit d. Indik. Thromboaggregationshemmung bzw. Infarktprophylaxe (bis 100 mg)u. ASS-halt. Mono-AM, die ausschliesslich fuer die analget. Indik. zugelassen sind (Schr. an BPI v. 22.10.96 u. 18.12.98).
Abschlussdatum: 21.12.1998
Stufenplan erfüllt: 0
Arzneimittelbezeichnung historisch
| Historische Arzneimittelbezeichnung | Gültig ab |
|---|---|
| Alka-Seltzer | 01.01.1978 |
| Alka-Seltzer classic | 13.06.1996 |
Copyright
Copyright: Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Rechercheergebnisse aus der Datenbank AMIce - Öffentlicher Teil und dem PharmNet.Bund-Arzneimittelinformationssystem dürfen ausschließlich zu folgenden Bedingungen und Zwecken maschinenlesbar gespeichert werden:
- Kurzzeitige Datenspeicherung bei der Datenausgabe
Der berechtigte Benutzer darf die online ausgegebenen Rechercheergebnisse für Zwecke des Umformatierens und Druck vorübergehend speichern. Ausdrucke dürfen nur für den eigenen Gebrauch bzw. für den internen Gebrauch innerhalb der Institution des berechtigten Benutzers hergestellt werden (maximal 25 Kopien).
Bei Recherchen durch Informationsvermittler gilt dies für den eigenen Gebrauch des Auftraggebers sinngemäß. Der Rechercheur muss sicherstellen, dass das Copyright des Lizenzgebers dem Kunden bekannt ist; die Ausdrucke sind zu kennzeichnen mit "BfArM; Bonn - Unbefristete Datenspeicherung (Mitspeichern auf dem eigenen PC) oder Nutzung des Auftragstyps Standard bzw. des Parameters USE=STD (Übermittlung auf maschinenlesbaren Datenträgern durch E-Mail)
a) Die Speicherung über längere Zeit und wiederholte Nutzung der Daten ist für den eigenen Gebrauch erlaubt. Kopieren der gesamten Datenbank ist aus Gründen der Aktualität nicht sinnvoll und deshalb nicht erlaubt. Der berechtigte Benutzer darf die Daten außerdem Mitarbeitern seiner Institution zum internen Gebrauch zugänglich machen.
b) Der Benutzer erkennt an, dass das Copyright und alle Rechte an den Daten beim BfArM liegen. Er stellt sicher, dass dies den Nutzern der Datenbanken ebenfalls bekannt gemacht ist.
c) Die Daten dürfen nicht weiter kopiert, verbreitet oder verkauft werden. - Bei weitergehender Verwendung der Daten ist vorher die Genehmigung des Datenbankherstellers BfArM einzuholen.
Die o.g. Bestimmungen über die Vervielfältigung, Verbreitung oder den Verkauf der Daten in maschinenlesbarer Form gelten ebenso für die gedruckten Daten.
Gewährleistung
Die angebotenen Daten wurden mit der üblicherweise notwendigen Sorgfalt nach bestem Gewissen zusammengetragen und aufbereitet. Das BfArM übernimmt jedoch keine Gewähr für Aktualität, Korrektheit, Vollständigkeit oder Richtigkeit der Daten. Alle Daten geben stets den Stand zu dem in der Information genannten Zeitpunkt wieder. Viele Informationen können nach diesem Zeitpunkt durch Überprüfung in Widerspruchs- oder Klageverfahren oder durch Änderungsanzeigen beeinflusst werden; eine Aktualisierung der Informationen kann aus rechtlichen oder tatsächlichen Gründen in vielen Fällen erst später erfolgen. Haftungsansprüche gegen das BfArM aufgrund von Schäden aller Art, die durch die Nutzung der angebotenen Informationen oder durch die Nutzung fehlerhafter oder unvollständiger Informationen verursacht wurden, sind grundsätzlich ausgeschlossen, sofern kein vorsätzliches oder grob fahrlässiges Verhalten nachgewiesen wird.
Kontakt
Hersteller
Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)
Kurt-Georg-Kiesinger-Allee 3
53175 Bonn
Tel: +49 (0)228 99 307-0
Fax: +49 (0)228 99 307-5207
Bundesamt für Verbraucherschutz und Lebensmittelsicherheit (BVL)
Bundesallee 50, Gebäude 35
38116 Braunschweig
Internet: http://www.bvl.bund.de
Paul-Ehrlich-Institut (PEI)
Paul-Ehrlich-Str. 51-59
63225 Langen
Tel.: +49 (0)6103 77 0
Fax: +49 (0)6103 77 1234
Internet: http://www.pei.de
Ansprechpartner
Für inhaltliche Fragen:
BfArM
Tel.: +49 (0)228 99 307-0
E-Mail: amanda-support@bfarm.de
PEI
Tel.: +49 (0)6103 77 0
E-Mail: amanda-kontakt@pei.de
BVL
Tel.: +49 (0)30 18 445-7111
E-Mail: amanda@bvl.bund.de
Datenbankrecherche Arzneimittel:
BfArM
E-Mail:
amgui@bfarm.de
Technik, Vertrag, Preise:
BfArM
Helpdesk Technik
