Tamoxifen
12.07.2023
Aktuelle Informationen des BfArM zur eingeschränkten Verfügbarkeit von tamoxifenhaltigen Arzneimitteln
Im Januar 2022 wurden dem BfArM über das Lieferengpass Online-Portal die eingeschränkten Verfügbarkeiten für tamoxifenhaltige Arzneimittel in einem Umfang mitgeteilt, die zu einer umgehenden Kritikalitätsprüfung führte. Der Wirkstoff Tamoxifen ist Bestandteil der Liste versorgungsrelevanter Wirkstoffe. Arzneimittel mit diesem Wirkstoff, deren Marktanteil 25 Prozent und mehr beträgt, unterliegen der Selbstverpflichtung zur Meldung.
12.07.2023 - Aufhebung der Bekanntmachung nach § 79 Absatz 5 AMG
Mit Datum vom 07. Juli 2023 wurde per Bekanntmachung der Versorgungsmangel von tamoxifenhaltigen Arzneimitteln (BAnz AT 18.02.2022 B6) aufgehoben.
11.07.2022 – Hinweise an Apotheken zur aktuellen Versorgungslage mit tamoxifenhaltigen Arzneimitteln
Nach derzeitigem Kenntnisstand sind die vollversorgenden pharmazeutischen Großhandlungen zur Zeit mit ausreichend tamoxifenhaltigen Produkten bevorratet um die Versorgung der Bevölkerung angemessen gewährleisten zu können. Durch eine ungleichmäßige Verteilung der Bestände in der Fläche kann es im Einzelfall und in Abhängigkeit von der vertraglich geregelten Belieferung der Apotheken dazu kommen, dass Apotheken keine Möglichkeit haben Tamoxifen zu beziehen. In diesen Fällen wird dringend empfohlen andere vollversorgende Großhandlungen für die Belieferung heranzuziehen. Weiterhin werden aufgrund der nach wie vor geltenden Anordnung an den vollversorgenden pharmazeutischen Großhandel die tamoxifenhaltigen Produkte separiert gelagert und in den Warenwirtschaftssystemen als Importware mit spezifischem Vertriebsweg gekennzeichnet. Eine Bestellung der fraglichen Produkte ist daher in vielen Fällen ausschließlich telefonisch möglich. Wir bitten Sie diese Hinweise bei der Versorgung Ihrer Patientinnen und Patienten zu berücksichtigen.
09.05.2022 – Empfehlung des BfArM zur Abgabemenge tamoxifenhaltiger Fertigarzneimittel
Die dem BfArM vorliegenden Informationen zeigen, dass sich aufgrund der getroffenen Maßnahmen die Versorgungslage stabilisiert. Konkret bedeutet dies, dass in der Summe der noch zur Verfügung stehenden importierten Arzneimitteln und den bereits regulär verfügbaren Arzneimitteln eine hinreichende Versorgung erreicht werden kann, sofern keine Überbevorratungen stattfinden. Aus diesem Grund ist die empfohlene prioritäre Abgabe von 30er-Packungen (N1) ab sofort nicht mehr erforderlich. Das BfArM empfiehlt bei einer Verordnung einer Packungsgröße N3 (bis zu 100 Tabletten), die verfügbaren kleinen Packungsgrößen à 30 Tabletten der gemäß § 79 Abs. 5 AMG importierten Arzneimittel zu bündeln. Auf die Anordnung gemäß § 52b Absatz 3d AMG an den Großhandel vom 22.04.2022 zur primären Abgabe importierter Arzneimittel wird ausdrücklich hingewiesen.
22.04.2022 - Anordnung gemäß § 52b Absatz 3d AMG zu Maßnahmen zur Abmilderung des Versorgungsengpasses mit tamoxifenhaltigen Arzneimitteln
Das BfArM ordnet gemäß § 52b Absatz 3d AMG gegenüber vollversorgenden pharmazeutischen Großhandlungen eine bevorzugte Abgabe der tamoxifenhaltigen Importarzneimittel zur Abmilderung des Versorgungsengpasses an:
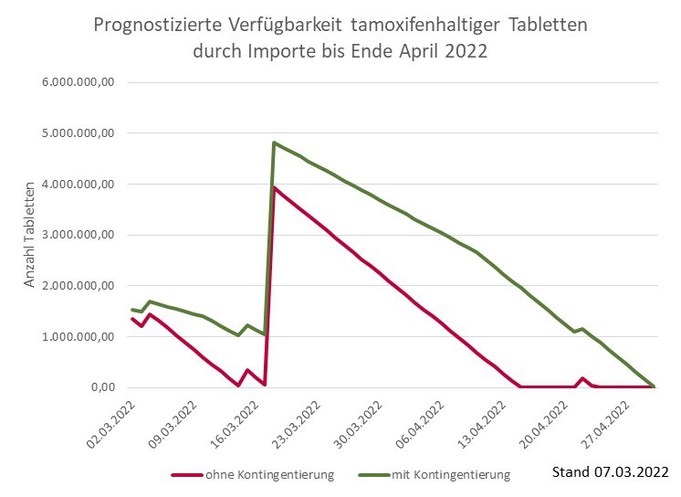
03.03.2022 - Appell des Beirates für Liefer- und Versorgungsengpässe an Ärzte und Ärztinnen sowie Apotheker und Apothekerinnen zur Verordnung und Abgabe tamoxifenhaltiger Arzneimittel bis Ende April 2022
Das BfArM hat den Beirat für Liefer- und Versorgungsengpässe nach § 52b Absatz 3b des Arzneimittelgesetzes (AMG) in einer Sondersitzung am 02.03.2022 über den aktuellen Stand zum Versorgungsmangel tamoxifenhaltiger Arzneimittel informiert.
Auf der Grundlage der Bekanntmachung nach § 79 Absatz 5 AMG wurden von den Landesbehörden mittlerweile Importe für mehr als 5 Mio. Tabletten tamoxifenhaltiger Arzneimittel bezogen auf die Stärke 20 mg gestattet. Diese sind bereits im Markt angekommen bzw. werden bis zum 15.03.2022 in den Verkehr gebracht werden. Spätestens im Mai 2022 werden nach derzeitiger Planung weitere 20 Mio. Tabletten in der Stärke 20 mg in den Verkehr gebracht werden.
Mit den aktuell zur Verfügung stehenden Arzneimitteln kann die Versorgung aller Patientinnen und Patienten sichergestellt werden, wenn die vom Beirat in der 7. Sitzung beschlossenen Maßnahmen der konsequenten Verordnung und gleichmäßigen Abgabe von kleinen Packungsgrößen (30 Tabletten) anstatt der üblichen 100 Tabletten erfolgt.
Der Beirat appelliert an die Ärzte und Ärztinnen ebenso wie an und Apotheker und Apothekerinnen, diesen Empfehlungen zu folgen. Nur so kann eine Versorgung aller Patientinnen und Patienten bis Mai 2022 gelingen. Die Verordnung von Großpackungen (N3) für einzelne Patientinnen und Patienten in den kommenden Wochen kann hingegen dazu führen, dass die verfügbaren Arzneimittel bereits vor dem ersten Mai ungleichmäßig verteilt sein werden. Aufgrund der zugesicherten Lieferungen ist davon auszugehen, dass sich die Versorgungslage ab Mai 2022 deutlich entspannen wird.
22.02.2022 - Anordnung gemäß § 52b Absatz 3d AMG über Maßnahmen zur Abmilderung des Versorgungsengpasses mit tamoxifenhaltigen Arzneimitteln
Das BfArM ordnet gemäß § 52b Absatz 3d AMG gegenüber pharmazeutischen Unternehmen und Großhandlungen Maßnahmen zur Abmilderung des Versorgungsengpasses tamoxifenhaltiger Arzneimittel an:
22.02.2022 - Informationsschreiben des Bundesministeriums für Gesundheit an die betroffenen Akteure im Gesundheitswesen
Das Bundesministerium für Gesundheit informiert in dem publizierten Schreiben über aktuelle Maßnahmen und die derzeitige Versorgungssituation. Alle Akteure, die an der Verschreibung und Distribution von Arzneimitteln beteiligt sind, werden Empfehlungen ausgesprochen, wie die derzeitige Situation gehandhabt werden soll:
18.02.2022 - Versorgungsmangel nach § 79 Absatz 5 AMG
Das Bundesministerium für Gesundheit macht auf Grund des § 79 Absatz 5 des Arzneimittelgesetzes (AMG) bekannt:
Erteilte Gestattungen nach § 79 Absatz 5 AMG:
| Datum | MAH | Produktname | Packungs-Größe | Stärke (in mg) | Chargen Nr. | PZN |
|---|---|---|---|---|---|---|
| 18.02.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2090314 | 18039126 |
| 18.02.2022 | ALIUD Pharma GmbH | Tamoxifene EG 10 mg compresse rivestite con film | 30 Tabletten | 10 | B213453 | 18033158 |
| 18.02.2022 | ALIUD Pharma GmbH | Tamoxifene EG 20 mg compresse rivestite con film | 20 Tabletten | 20 | B213885 | 18033164 |
| 21.02.2022 | Aristo Pharma GmbH | Tamoxifen Aristo 20 mg Tabletten | 10 Tabletten | 20 | 45904139 | n.a. |
| 21.02.2022 | Aristo Pharma GmbH | Tamoxifen Aristo 20 mg Tabletten | 10 Tabletten | 20 | 45906520 | n.a. |
| 23.02.2022 | ratiopharm GmbH | Tamoxifen 10 PCH - Niederlande | 30 Tabletten | 10 | 106901 | 18036180 |
| 23.02.2022 | ratiopharm GmbH | Tamoxifen 10 mg Tablets - UK | 30 Tabletten | 10 | 111660 | 18036174 |
| 02.03.2022 | AstraZeneca GmbH | Nolvadex-D | 56 Tabletten | 20 | RY529 | n.a. |
| 09.03.2022 | Arcana Arzneimittel GmbH | Tamoxifen Arcana Tabletten | 30 Tabletten | 20 | 00490A | n.a. |
| 17.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2093652 | 18039126 |
| 17.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2093653 | 18039126 |
| 17.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2093646 | 18039126 |
| 17.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2093651 | 18039126 |
| 29.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2096070 | 18039126 |
| 29.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2096076 | 18039126 |
| 29.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2096077 | 18039126 |
| 29.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2096079 | 18039126 |
| 29.03.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2096419 | 18039126 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6021 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6221 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6321 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6421 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6521 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6621 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6721 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6821 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN6921 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7021 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7121 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7221 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7321 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7421 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7521 | 18087295 |
| 07.04.2022 | Tillomed Laboratories Ltd | Tamoxifen 20mg Tablets – UK | 30 Tabletten | 20 | ATXBN7621 | 18087295 |
| 12.04.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 10 mg | 100 Tabletten | 10 | 2094767 | 18075493 |
| 31.05.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 10 mg | 100 Tabletten | 10 | 2101663 | 18075493 |
| 31.05.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2101666 | 18039126 |
| 17.06.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2106932 | 18039126 |
| 16.09.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 10 mg | 100 Tabletten | 10 | 2101663 | 18075493 |
| 16.09.2022 | Orion Pharma AG Schweiz | TAMOXIFEN FARMOS 20 mg | 100 Tabletten | 20 | 2117178 | 18039126 |
11.02.2022 - Beirat für Liefer- und Versorgungsengpässe beschließt Maßnahmenpaket zur Abmilderung der Lieferengpässe bei tamoxifenhaltigen Arzneimitteln
In der Sitzung am 9. Februar 2022 wurden vom Beirat für Liefer- und Versorgungsengpässe nach § 52b Absatz 3b des Arzneimittelgesetzes (AMG) einstimmig verschiedene Maßnahmen zur Abmilderung der Lieferengpässe bei tamoxifenhaltigen Arzneimitteln beschlossen. Mit diesen kurz- und langfristigen Maßnahmen soll zum einen die Versorgung der auf tamoxifenhaltige Arzneimittel angewiesenen Patientinnen und Patienten sichergestellt werden und zum anderen Sicherheit in Bezug auf die Erstattung geschaffen werden.
09.02.2022 - Empfehlungen der wissenschaftlich medizinischen Fachgesellschaften vom 09.02.2022
Die Fachgesellschaften haben eine gemeinsame Empfehlung zur Handhabung des Lieferengpasses von Tamoxifen veröffentlicht:
FAQ
Wann wird Tamoxifen angewendet?
Tamoxifen ist ein fester Bestandteil der Behandlungsschemata bei Mammakarzinom und besonders bei Patientinnen vor der Menopause kaum zu ersetzen, da andere Antiöstrogene kaum Bedeutung zugemessen wird und Aromatasehemmer ein schlechteres Nebenwirkungsprofil aufweisen und daher mit LHRH-Analoga kombiniert werden müssen. Auch bei Therapien nach der Menopause wird neben der Behandlung mit einem Aromatasehemmer die adjuvante Therapie mit Tamoxifen häufig angewendet.
Weiterhin ist zu berücksichtigen, dass der Wechsel auf andere Wirkstoffgruppen in der Regel ein schlechteres Nebenwirkungsprofil mit sich bringt.
Zu den therapeutischen Alternativen (LHGH-analoga, Aromatasehemmer) liegen uns zum jetzigen Zeitpunkt keine Lieferengpassmeldungen vor.
Was ist ein Versorgungsmangel?
Auf Basis der Erkenntnisse des BfArM und unter Einbeziehung der Landesbehörden kann das Bundesministerium für Gesundheit einen Versorgungsmangel nach § 79 Absatz 5 Arzneimittelgesetz (AMG) feststellen. Bei dieser Feststellung handelt es sich um eine Ausnahmeermächtigung in versorgungskritischen Situationen, die nach sehr strengen Kriterien zu treffen ist und immer eine risikobasierte Prüfung beinhaltet. Sie ist die Voraussetzung dafür, dass die Landesbehörden/Aufsichtsbehörden im Einzelfall und befristetet von bestehenden Vorgaben des Arzneimittelgesetzes abweichen dürfen. Die Feststellung erfolgt durch eine Bekanntmachung des Bundesministeriums für Gesundheit, die im Bundesanzeiger veröffentlicht wird.
Im Fall von kritischen Lieferengpasssituationen bleibt den Apotheken oft nur das bürokratisch komplexe Verfahren der Einzelimporte, das in der Regel eine mehrtägige Vorlaufzeit für die Belieferung der individuellen Verschreibung bedeutet.
Eine Bekanntmachung nach § 79 Absatz 5 des Arzneimittelgesetzes ermöglicht die Versorgungsmöglichkeiten im Bedarfsfall zu flexibilisieren.
Konkret dürfen die zuständigen Landesbehörden auf dieser juristischen Grundlage gestatten, dass beispielsweise Import-Arzneimittel in Verkehr gebracht werden, die in Deutschland nicht zugelassen sind.
Diese Gestattungen werden für einen bestimmten Zeitraum gegenüber dem Zulassungsinhaber befristet. Nach Ablauf des Befristungszeitraumes ist es dem Zulassungsinhaber nicht mehr gestattet, Arzneimittel auf Basis der Ausnahmegenehmigung in Verkehr zu bringen. Arzneimittel, welche sich noch nach Ablauf der Ausnahmegenehmigung in den Distributionsstufen befinden, dürfen weiterhin abgegeben werden. Dies ist darin begründet, dass sie bei Erwerb rechtmäßig in Verkehr waren. In manchen Fällen haben die durch die Landesbehörde ausgestellten Gestattungen jedoch keinen konkreten Befristungszeitraum, da die Gestattung bis zum Ende des bekanntgegebenen Versorgungsmangels gilt.
Des Weiteren werden die Aufsichtsbehörden der Bundesländer ermächtigt Chargen von Arzneimitteln freizugeben, auch wenn diesen nicht die letztgenehmigte Version der Packungsbeilage beiliegt. Auch das Inverkehrbringen eines Arzneimittels in fremdsprachiger Aufmachung kann zugelassen werden sowie das Inverkehrbringen von in Deutschland nicht zugelassenen Arzneimitteln, sofern sie in dem Staat rechtmäßig in Verkehr gebracht werden dürfen, aus dem sie in den Geltungsbereich des deutschen Arzneimittelgesetzes verbracht werden.
Sobald die regelhafte bedarfsgerechte Verfügbarkeit wieder gewährleistet ist, wird die Ausnahmeermächtigung vom Bundesministerium für Gesundheit wiederum per Bekanntmachung aufgehoben.
Werden die Kosten für alternativ verordnete oder abgegebene Tamoxifen-Präparate von den Krankenkassen übernommen?
Gemäß Beiratsbeschluss vom 09.02.2022 hatte der GKV-Spitzenverband den Krankenkassen empfohlen, dass in dem Zeitraum des Versorgungsmangels tamoxifenhaltiger Arzneimittel von den Krankenkassen die Kosten für diese Arzneimittel übernommen werden.
Das bedeutet, dass
- Krankenkassen eventuelle Mehrkosten übernehmen, wenn keine anderen Produkte zur Verfügung stehen
- die ärztlichen Verschreibungen im Rahmen der Wirtschaftlichkeitsprüfung gesondert berücksichtigt werden sollen
- auf Retaxationen der ordnungsgemäßen Abrechnung solcher Verordnungen verzichtet wird
Es liegen bisher keine Informationen vor, dass Krankenkassen der Empfehlung des GKV-Spitzenverband nicht folgen.
Darf ein Pharmazeutischer Unternehmer aufgrund der Anordnung des BfArM nach § 52b Absatz 3d AMG vom 22.02.2022 weiterhin tamoxifenhaltige Arzneimittel an den Großhandel abgeben?
Ja, mit der Anordnung soll sichergestellt werden, dass tamoxifenhaltige Arzneimittel, die z.B. über § 79 Absatz 5 AMG zur Abmilderung des Versorgungsengpasses verfügbar gemacht und möglichst vielen Patientinnen in Deutschland zur Verfügung gestellt werden können. Dieses soll vorzugsweise über die normalen Handelsstrukturen über den Großhandel erfolgen.
Muss dem Großhandel die ärztliche Verordnung vorliegen, um aufgrund der Anordnung des BfArM nach § 52b Absatz 3d AMG vom 22.02.2022 ein tamoxifenhaltiges Arzneimittel an eine Apotheke beliefern zu können?
Nein, für die Bestellung muss der Apotheke die Verschreibung einer ärztlichen Person vorliegen. Die Belieferung durch den Großhandel an eine öffentliche Apotheke oder Krankenhausapotheken kann erfolgen, wenn eine Zusicherung abgegeben wird, dass die Bestellung auf der Basis einer ärztlichen Verordnung erfolgt. Die anonymisierten ärztlichen Verordnungen sind von den öffentlichen Apotheken oder Krankenhausapotheken als Beleg für die Zeitraum des Versorgungsengpasses aufzubewahren.
